Medisinske senger kan også kalles medisinske senger, medisinske senger, pleiesenger osv. Det er senger som brukes av pasienter når de er innlagt på sykehus. De brukes hovedsakelig på store sykehus, township helsesentre, samfunnshelsesenter, etc.
US FDA krever at når matvarer og medisinske produkter kommer inn på det amerikanske markedet, må de registreres på US FDAs offisielle nettside før de kan gå inn på det amerikanske markedet.
Sykehussenger er klassifisert som medisinsk utstyr i klasse I i FDA. US Food and Drug Administration definerer klasse I-enheter som "ikke ment å brukes til å opprettholde liv eller opprettholde liv, eller å være viktig for å forhindre skade på menneskers helse, og kan ikke presentere potensielle" enheter som utgjør en urimelig risiko for sykdom eller skade." Disse enhetene er den vanligste kategorien enheter regulert av FDA, og står for 47 % av godkjente enheter på markedet. Klasse I-enheter har minimal pasientkontakt og har minimal innvirkning på pasientens generelle helse. Klasse I-enheter kommer vanligvis ikke i kontakt med pasientens indre organer, sentralnervesystem eller kardiovaskulære system. Disse enhetene er underlagt minimale regulatoriske krav.
FDA-sertifisering av medisinsk utstyr inkluderer: produsentregistrering hos FDA, produkt-FDA-registrering, produktoppføringsregistrering (510-skjemaregistrering), produktoppføring (PMA-gjennomgang), merking og teknisk transformasjon, fortolling, registrering og førmarkedsrapportering av medisinsk og helsevesenet utstyr, Følgende materialer må sendes inn:
(1) Fem kopier av ferdigpakkede ferdige produkter
(2) Enhetsstrukturdiagram og tekstbeskrivelse
(3) Ytelse og arbeidsprinsipp for enheten
(4) Sikkerhetsdemonstrasjon eller testmateriale for enheten
(5) Introduksjon til produksjonsprosessen
(6) Sammendrag av kliniske studier
(7) Produktinstruksjoner. Dersom apparatet har radioaktive egenskaper eller frigjør radioaktivt materiale, skal det beskrives i detalj.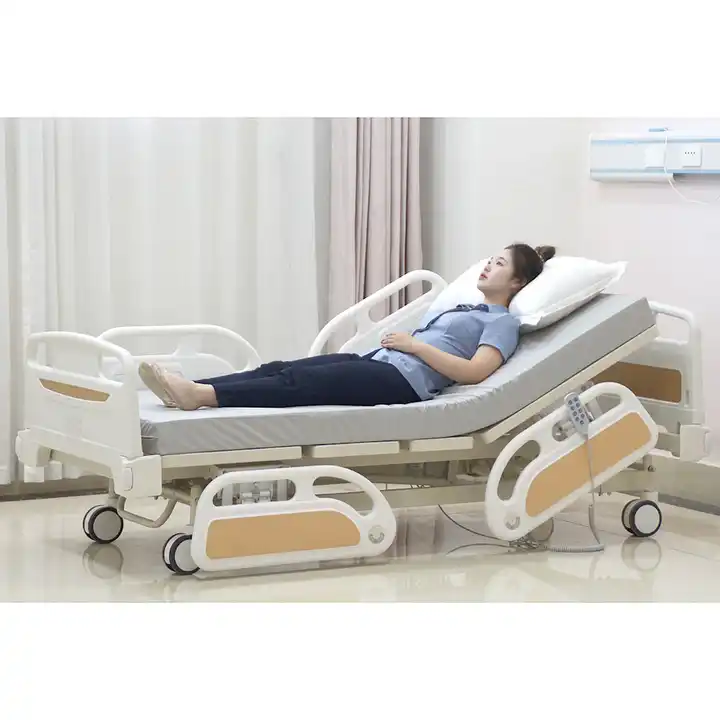
Prosjektsyklus
Tiden fra FDAs evaluering til endelig godkjenning er vanligvis lengre og kontrolleres av FDA; vanligvis er hele den normale prosesssyklusen omtrent 12 måneder
510K søknadsprosessen for sykehussenger er som følger:
1. Samsvarskrav for tekniske dokumenter i FDA 510(K).
2. Standardanalyse som gjelder for US FDA 510k-registrering
3. Bekreftelse på tilgjengelighet av eksisterende dokumenter
4. Innsamling og sammenligning av registrerte produkter på markedet
5. Forbered produktinformasjon i samsvar med US FDA 510k krav
6. Forbered 510k registreringsdokumenter i henhold til standarder
7. Foreta revisjoner basert på gjennomgangsresultatene til registreringsdokumentene
8. Fullfør firmaregistrering og produktoppføringsregistrering
taishaninc har global eksportsertifisering
Det har 5 heleide datterselskaper
Dekker industri for byggematerialer, kjemikalier og medisinsk utstyr
Vi er en fabrikk med global eksportsertifisering, med en årlig produksjonsverdi på $5 000 000 og eksporterer til mer enn 160 land rundt om i verden. Vi er den største integrerte industriparkfabrikken i nærområdet. Om nødvendig, vennligst kontakt oss i tide og send detaljert produktinformasjon.
Innleggstid: 21. november 2023




